| Dictionnaire médical |
A Ab Aba Abcè Abcé Abdo Abdomi Abdu Abio Ablu Abor Abou Abra Abru Abréviations Abso Aca Acan Acanth Acar Acat Ace Acep Acet Ach Ache Achi Achl Achlor Acho Achr Achro Aché Acid Acin Acné Acor Acou Acro Acti Actin Actino Acu Acui Acum Acup Acya Acyl Acys Acép Acét Adac Addi Addu Adia Adip Adré Adrén Adyn Adén Affe Affé Agal Agas Aggl Agglut Agna Agno Agom Agor Agra Agry Agén Aine Aire Akin Alal Albi Albu Alca Alco Alcool Aldo Aldé Alec Aleu Alex Alg Algh Algi Algo Algé Alit Alle Allerg Allo Allè Allé Alog Alop Alph Alpha Alvé Alvéol Alym Amar Amau Amb Ambi Ambl Ambly Ami Amib Amid Amido Amim Amin Amit Ammo Amni Amné Amon Amor Amph Amphi Ampho Ampo Ampu Ampull Amy Amyc Amyg Amygda Amyl Amyo Amyx Amyè Amyé Amb Amèl Amél Amét An Ana Anab Anad Anal Anam Anap Anas Anat Anaé Andr Ane Anen Aner Anes Aneu Ang Angi Angin Ango Angé Anh Anhi Anhy Anhé Anis Anit Anky Ankyl Anne Annu Anod Anom Anop Anor Anos Anot Anov Anox Ant Anta Anth Anthra Anthro Anti Antr Anté Anur Anus Anxi Ans Ané Anéc Aném Anér Anév Anévri Aort Ap Apat Apep Apex Aph Apha Aphi Apho Apht Aphy Apic Apip Apl Apla Apn Apo Apod Apol Apon Apop Appa Appe Append Appé Apr Apra Apro Apy Apyr Aqua Aque Arac Arachn Arch Arno Arom Arth Arthr Artè Arté Artéri Ary Aryt Arytén Aréf Aréo Asci Asep Asex Asia Aspe Asph Asta Asth Asthm Asti Astr Astro Asym Asyn Asys Atax Athr Athy Athé Athér Aton Atop Atri Atro Atré Atti Attic Atyp Atél Audi Auri Auti Auto Avol Avul Ax Axia Axil Axis Axon Axoï Azog Azop Azor Azos Azot Azym Aér Aéra Aéro alph
| Azote (cycle de l') | |
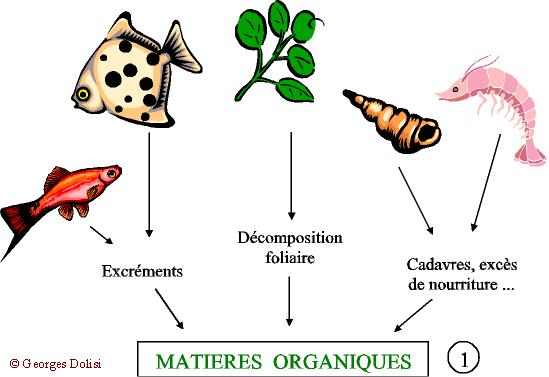
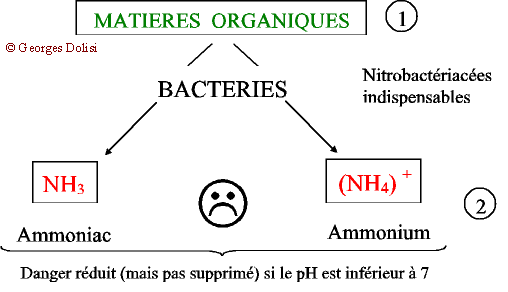
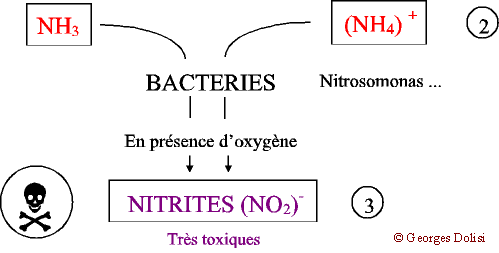
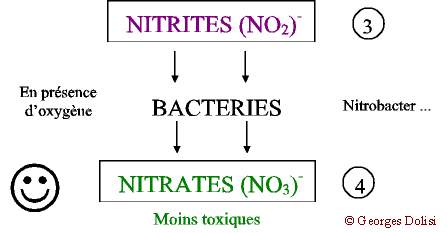
| Biochimie N. m. * cycle : du grec kuklos {cycl(o)-, -cycle, -cyclique}, cercle, roue ; * azote : du préfixe a privatif et du grec zôê , la vie. {azot(o)-, -azoïque} : lazote ne permet pas la vie ; qui contient de lazote. Il faut le reconnaître, le problème nest pas très simple à comprendre si lon na pas quelques connaissances élémentaires de chimie, car l'azone atmosphérique N2 va subir une série de transformations dans les différents compartiments de la biosphère (atmosphère, hydrosphère, lithosphère), ce qui justifie l'adjectif biogéochimique. Lazote et ses dérivés font cependant partie des produits qui peuvent bouleverser léquilibre d'un milieu, de la flaque d'eau en passant par un aquarium, un étang, un lac jusqu'à la mer. I - L AZOTE Son symbole chimique est la lettre « N » qui vient du mot « Nitrogène », autre nom plus ancien de lazote. Lair en contient 79 % mais ni les animaux, ni les plantes aquatiques ne peuvent labsorber à létat gazeux. Remarque : on sait aujourdhui que certaines bactéries (Rhizobium) fixées sur les racines de légumineuses forment des produits capables de transformer directement lazote de lair en engrais azotés. En retour, grâce à la photosynthèse, la plante fournit aux bactéries des substances nutritives. Cette symbiose est utilisée actuellement au Sahel avec les acacias. Pour en savoir plus, quelques articles un peu anciens mais très intéressants : La Recherche de janvier 1985 : « Fixation de lazote et agriculture tropicale » ; La Recherche de mai 1988 : « Les engrais verts à lhonneur » ; La Recherche de juin 1991 : « Les acacias fixateurs dazote du Sahel ». Dans la nature, lazote est combiné à dautres substances provenant essentiellement de la décomposition des matières organiques, animales et végétales. On parle alors de composés azotés. II - DANS UN MILIEU FERMÉ (aquarium, étang ...) Pour bien comprendre ce qui se passe dans ce milieu, je vous propose un schéma évolutif en quatre parties essentielles : * formation des matières organiques, * transformation en ammoniac et ions ammonium, * apparition des nitrites toxiques, * nouvelle transformation en nitrates. 1 - Décomposition : Malgré tous les systèmes de filtration et de nettoyage de leau, il reste toujours des matières organiques provenant de la décomposition des végétaux et des surplus daliments, ainsi que des excréments des poissons et invertébrés et de leurs cadavres. A ce stade, on peut intervenir en limitant les apports nutritionnels (organiques) et en enlevant immédiatement les poissons morts. Ces quelques précautions limiteront la quantité de matières organiques de leau. 2 - Ammonisation A partir de ces matières organiques et grâce à laction de nombreuses bactéries présentes dans le sol, sur les matières filtrantes et tous les supports, deux produits vont apparaître dans leau : * Lammoniac : NH3 très toxique et très soluble dans leau * Les ions ammonium : (NH4) + de toxicité moindre. Il est actuellement reconnu que ces deux facteurs vont varier en fonction du pH (signifie « potentiel Hydrogène : cest le degré dacidité ou de basicité - syn. alcalinité - de leau) et quils seront nettement moins dangereux si ce pH est inférieur à 7, cest-à-dire si leau est légèrement acide. REMARQUE : pour les aquariophiles, on voit ici limportance de surveiller soigneusement leau dun aquarium marin, où le pH est normalement basique. 3 - Nitrosation et apparition des nitrites Un autre groupe de bactéries (Nitrosomonas par exemple) est capable, en présence doxygène de transformer lammoniac et les ions ammonium en nitrites : (NO2) - . Ces bactéries ayant besoin doxygène pour faire ces transformations, il est très important davoir * une eau bien aérée dont la surface n'est pas colmatée par des algues flottantes, * une eau non stagnante et surtout : * un sol permettant la circulation de leau, donc à granulométrie assez grossière. 4 - Nitratation Cest la dernière étape de la dégradation qui aboutit, grâce à dautres bactéries (Nitrobacter par exemple), à la formation de nitrates qui ne sont dangereux quà des concentrations importantes. Cette dernière étape se fait aussi par oxydation. III) NITRIFICATION : bilan et conditions Matières organiques ---> ammoniac et ions ammonium ---> nitrites ---> nitrates. Quand cette chaîne de réactions se produit correctement, lavantage permanent est que, à partir dun produit très toxique (ammoniac), on obtient un composé peu dangereux pour les êtres vivants (nitrates) et qui sert daliment aux plantes, donc qui va progressivement disparaître. Les plantes absorbent aussi une petite partie des nitrites.
© Georges Dolisi | |
| < vers le menu principal | Politique de confidentialité | App Privacy Policy | Contact | ^ haut de la page |
| © 2006, 2020 Medicopedia | Powered by JIMaroc |