| Dictionnaire médical |
Abréviations T Tach Tala Talo Talu Tamp Tars Tart Tato Temp Tend Test Text Thal Than Ther Thor Thro Thym Thyr Thèq Thé Théc Thér Tibi Tiss Titr Toco Tolé Tomo Tona Toni Tono Tons Tonu Tope Topi Topo Torp Tors Tort Toru Tous Toux Toxi Toxo Toxé Trab Trac Trag Trai Tran Trau Trep Tri Tria Tric Trig Trim Trip Tris Trit Troc Troi Trom Tron Trop Tryp Trép Tuba Tube Tubo Tubu Tubé Tumo Tuph Tuss Tymp Type Typh Typo Tyro Tæni Téla Télo Télé Téne Téni Téno Téra Téta Tétr
| Tampon (système) | |
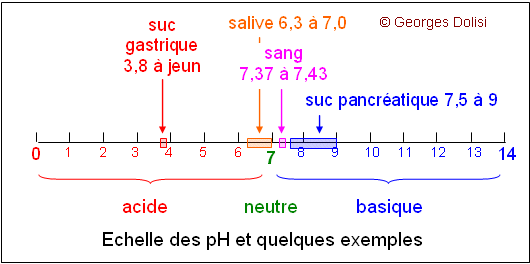
| Biochimie, chimie organique Adj. et substantif. * système : du grec sustêma {système}, assemblage ; * tampon : tampon est la nasalisation de tapon, issu du francique tappo, bonde, soupape, bouchon. Petit rappel préalable sur le pH, abréviation de potentiel hydrogène. La lettre H représente l'atome d'hydrogène. En effet, le pH est la mesure de l'acidité ou de l'alcalinité (ou basicité) d'une solution. Ce potentiel hydrogène est obtenu par le logarithme décimal (log) de l'inverse de la concentration en ions H+ d'une solution. Ces ions H+ proviennent de la dissociation de l'eau selon la formule H2O <--> H+ + OH- (réaction réversible). Il y a donc toujours autant d'ions H+ que d'ions OH-. On a montré expérimentalement que le produit des ions H+ et OH- reste toujours égal à 10-14 et que, dans une eau neutre à 15°C, [H+] = [OH-] = 10-7. Un composé est dit acide quand il libère, par dissociation, plus d'ions H+ que d'ions OH- ; il est basique (ou alcalin) quand il libère plus d'ions OH- que d'ions H+. L'échelle des pH va donc de 0 à 14, avec la valeur zéro pour une solution normale d'acide ayant une concentration unitaire d'un équivalent-gramme par litre et entièrement dissociée en ions hydrogène. De même la valeur 14 pour une solution normale d'alcali fort. La pH-métrie est le fait de mesurer le pH d'une solution. Exemple : dans les RGO (ou reflux gastro-sophagiens), on mesure le pH de l'sophage. Le RGO est confirmé par un pH acide. Dans un organe ou dans notre milieu intérieur par exemple, il existe un système tampon (ou plusieurs substances tampon) dont le rôle est d'amortir les variations de la concentration en ions hydrogène H+, c'est-à-dire de maintenir le pH constant, quels que soient les ajouts de bases ou d'acides. Les tampons sont souvent des mélanges d'une base faible et d'un sel de cette base avec un acide fort, ou le plus souvent d'un acide faible et d'un sel de cet acide avec une base forte. Dans notre milieu intérieur et en particulier dans le sang, le système tampon le plus important est formé par l'ensemble CO3H2 / CO3NaH, c'est-à-dire acide carbonique / bicarbonate de sodium.
© Georges Dolisi | |
| < vers le menu principal | Politique de confidentialité | App Privacy Policy | Contact | ^ haut de la page |
| © 2006, 2020 Medicopedia | Powered by JIMaroc |